
Pulsa para escuchar el artículo
ENVASES AUTOCALENTABLES Y AUTOENFRIABLES PARA ALIMENTOS Y BEBIDAS
Por Juan Pablo Álvarez
Son unos envases especiales para alimentos y bebidas, su misión es calentar o enfriar bebidas comerciales. Aparte de almacenar un alimento o un líquido, en su interior se van a desarrollar unos procesos químicos con el fin de obtener energía. Sea con lo que sea, debemos saber que la energía es única, lo que si es variado son las formas que se puede adoptar, en este caso sería la energía interna o térmica.
Esta energía interna se manifiesta al exterior en forma de temperatura. Por tanto la podemos clasificar a las formas de energía asociadas a las transformaciones químicas, radiaciones y cambios de composición. La denominaremos en este caso que nos ocupa como:
LA ENERGÍA DE LOS COMPUESTOS QUÍMICOS
Esos compuestos químicos son los que van a aportar energía, llamémosla positiva cuando aportan calor y negativa cuando aportan frío a los alimentos o bebidas. En este artículo expondremos unos compuestos químicos utilizados en los envases autocalentables y autoenfriables.
Empezaremos con los....
ALIMENTOS Y BEBIDAS AUTOCALENTABLES
La reacción que produce el calor necesario es:
CaO(s) + H2O (l) → Ca (OH)2(s)
Reacción, exotérmica es aquella que se produce con desprendimiento de calor. Es la misma reacción se produce al mezclar “cal viva” (CaO) con agua para formar “cal apagada” o Ca (OH)2, usada como material de construcción.
Obtención del calentamiento:
Disolución de cloruro cálcico en agua producirá calor. La variación de entalpía de disolución de esta sal en agua es del orden de -82,9 kJ/ mol.
Ejemplo de análisis de un producto tipo comercial:
Aplicación de aprovechamiento de la energía desprendida por la reacción química entre el óxido de calcio (trozos irregulares de varios mm, granulado, color grisáceo) y el agua (color procedente de colorante alimentario), para dar hidróxido de calcio. Sirve para calentar una bebida de café en un envase especial similar a los que se comercializan.
Se determinaron las siguientes cantidades:
Óxido de calcio (60 g) más gluconato sódico (aditivo alimentario E-576) a retardador de la reacción de hidratación, agua con color (23 g), bebida de café (206,20 g, ocupando un volumen de 200 ml)
Tipología del envase (basado en material de hojalata, hay de plástico y una pequeña lámina de aluminio) (100,56 g).
Calentamiento transferencia de calor: tres minutos
Moles CaO = 60,00 g / 56,08 g/mol = 1,07 mol (reactivo limitante).
Moles H2O = 23,00 g / 18,02 g/mol = 1,28 mol (reactivo en exceso).
Hay un exceso de 0,21 moles de agua, que suponen 3,78 g, y se podrán formar (si la reacción se produce con un rendimiento del 100%): 1,07 x 74,10 g/mol = 79,29 g Ca (OH)2
Mol Unidad de cantidad de materia del Sistema Internacional, equivale a la masa de tantas unidades elementales (átomos, moléculas, iones, electrones, etc.) como átomos hay en 0,012 kilogramos de carbono 12.
Seguidamente no está de más que...
ANALICEMOS UN ENVASE
Estructura de envases autocalentables
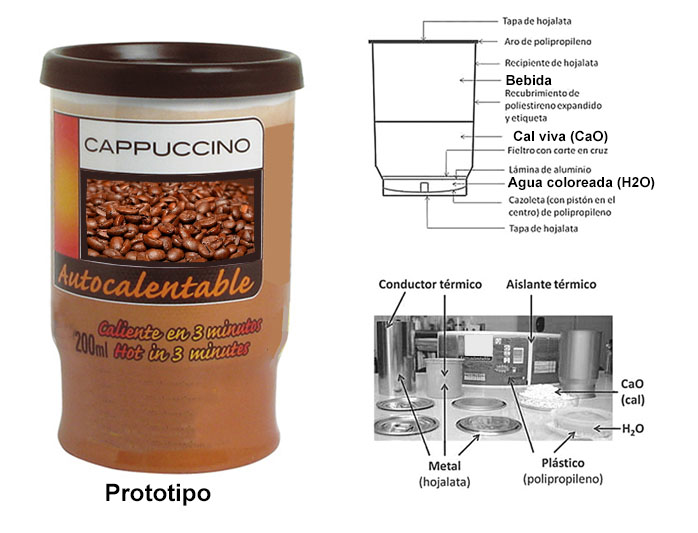
En el caso de los alimentos autocalentables, son dos las sustancias que se suelen incorporar, la del monóxido de calcio (CaO) que hemos explicado ampliamente y otra también aplicada por otros fabricantes, es el monóxido de magnesio (MgO) que, al disolverse en el agua, se transforma en hidróxido magnésico (Mg(OH)2), respectivamente.
Una vez que llevamos claro esto de los alimentos y bebidas autocalentables pasamos a...
ALIMENTOS Y BEBIDAS AUTOENFRIABLES
Finalmente vamos a dar una pincelada de dos ejemplos de reacciones endotérmicas que son las que absorben el calor de los alimentos o bebidas dando lugar al enfriamiento del producto.
PRODUCTOS Y QUÍMICA UTILIZADA
Nombre químico: Tiosulfato de sodio pentahidratado
Sinónimos: Hiposulfito de Sodio
Su estructura cristalina es de tipo : Monoclínico
Solubilidad en agua: 70.1 g/100 mL (20 °C)
Número CAS: 7772-98-7 Número RTECS: XN6476000
¿Cómo se produce el enfriamiento?
Disolución endotérmica de tiosulfato sódico pentahidratado, Na2S2O3 5H2O, en agua produce el enfriamiento.
La variación de entalpía de disolución de la sal es del orden de + 47,4 kJ/ mol.
Otro producto utilizado es:
El nitrato de amonio o nitrato amónico es una sal formada por iones nitrato y amonio.
Su fórmula es NH4NO3. Se trata de un compuesto incoloro e higroscópico, altamente soluble en agua.
Densidad: 1720 kg/m3; 1,72 g/cm3 Número CAS: 6484-52-2
Sº sólido: 151 J x mol NFPA 704: 0 2 3 OX
¿Cómo se produce el enfriamiento?
La reacción endotérmica que se produce al entrar en contacto con el agua es:
NH4NO3 (s) → NH+4 (aq) + NO-3 (aq)
Hºdisolución = 25,7 KJ/mol
NH4NO2 (s) → NH+4 (aq) + NO-2 (aq)
Hºdisolución = 19,3 KJ/mol
Las disoluciones en agua H2O del NH4NO3 hace que la temperatura del agua pueda pasar de 25 ºC a 1 ºC en pocos minutos.
EXISTEN APLICACIONES QUE NO SON PARA ALIMENTACION
Desde hace mucho tiempo siglo XX existen las bolsas de frio o calor de usar y tirar basadas en lo que anteriormente hemos explicado pues su fundamento químico es el mismo y su aplicación es diversa.














































